关于Class D类器械的IVDR修正案和政策
日期:2023年3月20日
2023 年3月20日,修订 MDR 和 IVDR 的 the Regulation (EU) 2023/607号法规在《欧盟官方公报》(Official Journal of the European Union, OJEU) 上公布,并立即生效。本次法规修订旨在化解当前的严峻形势,解决由于从医疗器械指令向MDR和IVDR法规的过渡不如预期而导致的欧盟医疗器械可能短缺的问题
IVDR 修正案
IVDR Article 110.4 中的销售(Sell off)条款已废除,允许已根据指令投放市场的遗留器械继续销售,不设截止日期。
BSI实施(EU) 2022/112和最新 IVDR修正案的计划
BSI对于最新的法规修正案以及去年发布的 (EU) 2022/112法规表示欢迎,因为它们既确保了安全的IVD器械上市,又为制造商和公告机构提供了更多的时间来完成IVDR法规的过渡。BSI除了执行新法规,同时与欧盟当局和其它公告机构密切合作,以达成对新修订法规的共识,开发相关模板,以支持新修订法规在所有公告机构间的协同实施。
包括此前(EU) 2022/112在内的最重要时间表如下:
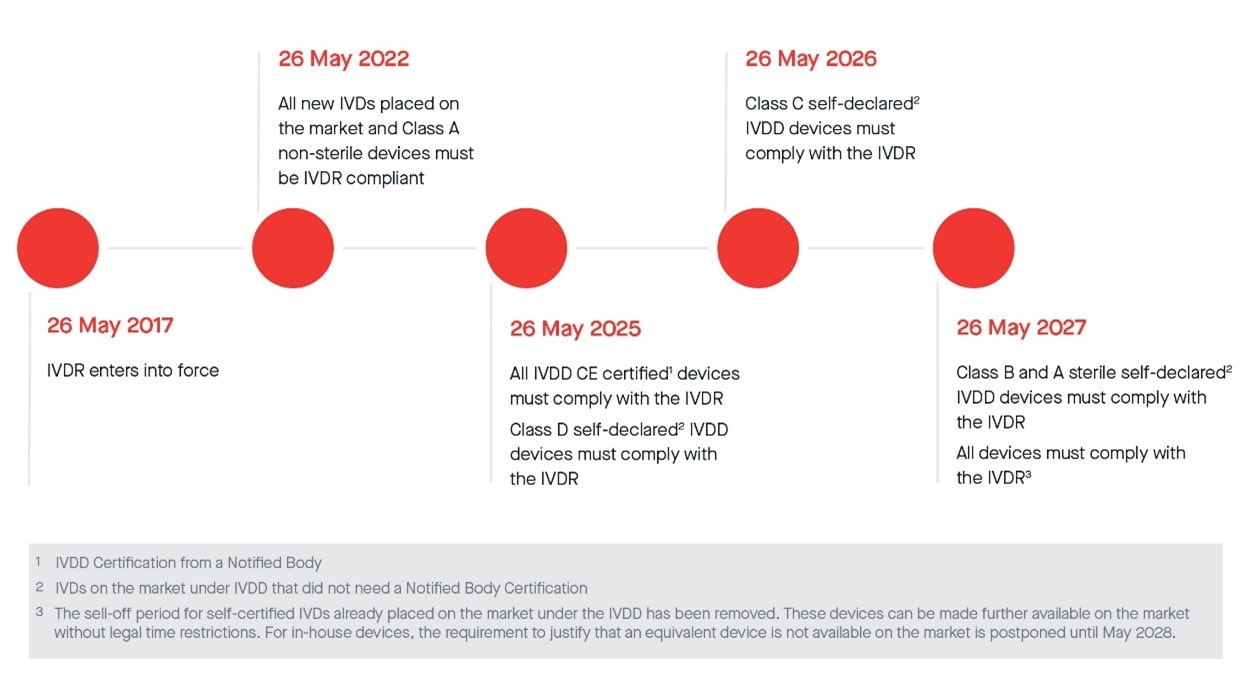
Class D 类器械相关政策,欧盟参考实验室 (EURL)待定
如您所知,BSI 采用了基于风险的方法对Class D器械的认证。我们将根据制造商的认证历史、器械风险和技术新颖性,有针对性地采用 Team-NB/NBCG Med 立场文件所述的方法。
在我们等待欧盟参考实验室授权期间,BSI 致力于探索各种方法,期望能够减轻在没有独立实验室验证的情况下认证Class D 类器械的风险,同时保证不降低 IVDR 对评审的要求。一旦有授权的欧盟参考实验室,我们将积极完成 Class D类器的过渡。
不建议制造商推迟IVDR计划
为了充分利用目前的产能完成 IVDR 过渡,BSI 强烈建议:已经根据2022年1月的立法向 BSI 提交或计划提交 IVDR 申请和技术文件的制造商切勿改变当前计划,同时强烈建议其他尚未提交 IVDR申请的制造商尽快提交申请,原因如下:
- 推迟或变更当前的提交计划,意味着提交的申请将重新进入排队列表等待评审,从而面临认证延迟的风险
- 在过渡性条款实行期间,制造商不得对其遗留器械的设计或预期用途进行重大变更
技术文件的评审工作会分配给相应具备IVR/IVP/IVS/IVD (或其组合)资格的技术专家。因此分配和开始评审的准备时间均会根据现有和未来工作量而变化。我们将根据技术专家的工作量,尽早安排和进行评审。在评审过程中,制造商的及时回复,可以确保评审更加高效。
请放心,BSI十分关注技术专家的评审工作量,确保他们都能尽量以最高效率满足制造商的认证需求。
哪里可以获取更多信息?
您可以访问BSI IVDR专题网页 ,获取其它支持信息和资源。如果您有其他问题,请联系您的认证经理。
我们的第一要务依然是维护患者安全,并确保在新的监管框架内对所有医疗器械进行合规的符合性审核。
BSI 衷心感谢您在过去几年所做的努力和取得的进展,并期待与您持续合作,协助您及时完成法规过渡。
Alex Laan
IVD 公告机构负责人
